Протизапальний, антиоксидантний, та метаболічний ефекти введення наночасток діоксиду церію при експериментальній пневмонії у щурів.
Протизапальний, антиоксидантний, та метаболічний ефекти введення наночасток діоксиду церію при експериментальній пневмонії у щурів.
Серебровська З.О. 1 , Портниченко В.И. 1, Шиш А.М. 1, Павлович С.И. 1, Доровських А.В. 2 , Лисенко В.С. 3 , Тертих В.А. 4, Больбух Ю. Н. 4, Досенко В.Е. 1
- Інститут фізіології ім. О.О.Богомольця НАНУ
- Науково-виробниче об’єднання «Міжнародний медичний центр»
- Інститутфізики напівпровідників імені В. Є. Лашкарьова НАНУ
- Інститут хімії поверхні ім.О.О.Чуйка НАНУ
Київ 2016
Резюме.
Вступ
Відомості про сильний протизапальний засіб, наночасточки діоксиду церію (CeO2 NP) є багатообіцяючими, при цьому, антиоксидантні властивості цього матеріалу вважаються основним, якщо не єдиним механізмом його дії. Показано, що падіння мембранного потенціалу мітохондрій, вхід кальцію, зменшення відношення NADH/NAD та концентрації АТФ, викликані обробкою перекисом водню, відновлюються після введення CeO2 NP (1). Ми припускаємо, що CeO2 NP може виступати в якості антиоксиданту і поліпшити вироблення енергії в інших фізіологічних і патологічних станах. Ми використали модель запалення легенів у щурів індукованого липополисахаридом (LPS) і вивчали біологічні ефекти CeO2 NP шляхом оцінки морфології легенів, активних форм кисню (ROS), експресії прозапальних цитокінів, поглинання кисню та інших характеристик вентиляції легень.
Методи
Тридцять шість щурів Wistar чоловічої статі, 5 місяців і 250-290 г були розділені на чотири групи: 1) інтактних тварин; 2) лікування СеО2 Н.П., 3) експериментальної пневмонії (в / б ін’єкції LPS, 1 мг / кг), і 4) експериментальна пневмонія лікується CeO2 NP (2,5 мг / кг). Легенева вентиляція і газообмін вимірювали чотири рази: до і 1, 3 і 24 год після ін’єкції LPS. МРНК TNF-alpha, IL-6, і CxCL2 визначали за допомогою ЗТ-ПЛР. Генерацію активних форм кисню (АФК) в плазмі крові і гомогенаті легеневої тканини вимірювали за допомогою lucigenin- і люмінолзавісімой посиленої хемілюмінесценції (ХЛ).
Результати.
Ендотоксемія в гострій фазі була пов’язана з: (1) поступовим зниженням VE (на 72%) і VO2 (на 62%), через 24 годин після ін’єкції LPS; (2) патологічними змінами в морфології легенів; (3) посилення експресії CxCL2 (на 68%); і (4) збільшення вироблення активних форм кисню в крові (на 660%) і легенях (на 33%).
При лікуванні щурів з ін’єкцією LPS за допомогою CeO2 NP не спостерігалося будь-якого зниження VE і VO2 через 1 годину після ін’єкції LPS, та спостерігалося збільшення VE (на 25%) і VO2 (на 20%) через 3 години після ін’єкції; цей ефект зберігався 24 години після ін’єкції.
Введення CeO2 NP контрольним щурам підвищило VE на 20% і VO2 на 45% в порівнянні з нульовим вимірюванням часу – до введення CeO2 NPs. Лікування щурів з ін’єкцією LPS за допомогою CeO2 NP призвело до зменшення патологічних відхилень в морфології легенів; суттєвої зміни в експресії маркерів запалення: зниження CxCL2 на 87% (р <0,01), зменшення IL-6 на 77% (р <0,05), зменшення TNF-a на 57% (р = 0,05); зменшення генерації активних форм кисню у крові на 67% (р <0,05) і зниження ROS легких гомогената тканини на 19% (р <0,05).
Висновок.
У нашому дослідженні ми показали, протизапальну і антиоксидантну дію CeO2 NP. Крім того, в цій роботі вперше показано, що введення CeO2 NP стимулює споживання кисню як у здорових щурів, так і у щурів із запаленням легенів. Ми припускаємо, що ключ до розуміння механізмів цих явищ лежать у властивості CeO2 NP поглинати АФК до риються ROS і потужним антиоксидантним впливом на АФК у мітохондріях.
Введення.
Біологічні властивості наночастинок діоксиду церію (CeO2 NP) недавно привернули до себе увагу в різних областях біомедичних досліджень. Біологічна активність CeO2 НП залежить від форми частинок, розміру, особливостей решітки, технології виробництва (2, 3, 4).
Можна простежити дві тенденції в загальному обсязі публікацій, присвячених CeO2 НП: (1) токсичність CeO2, який міститься в метаболічних побічних продуктів і інших забрудненнях, може накопичуватися в тканинах, особливо в легенях та печінці, викликаючи пошкодження (5, 6); і (2) потенційне застосування CeO2 НП в сільському господарстві та медицині. Одним з можливих застосувань є протиракова терапія: дослідження показали, що CeO2 NP є токсичними для ракових клітин, і мінімально шкідливі для нормальних тканин (7, 8, 9). Кілька досліджень in vitro вказують на цитопротекторну дію CeO2 НП в клітинах серця (10), моноцитів (11) і клітин підшлункової залози (12). Відомості про потужну проти-запальну дію CeO2 НП є багатообіцяючими, тому що показана їх ефективність на моделях перитоніту (13, 14), сепсису (15) вікової макулярної дегенерації (16.), світлового пошкодження сітківки ока (2), та інші. Складається враження, що антиоксидантні властивості CeO2 – це основний, якщо не єдиний механізм даного ефекту. (17, 18, 19). Антиоксидантний потенціал CeO2 NP є дуже високим, його можна порівняти з таким потужним агентом як супероксиддисмутаза. Як звичайний антиоксидант, CeO2 NP зменшує оксидативне пошкодження мембран і вловлюючи су пероксид, зменшує міграцію макрофагів і нейтрофілів в запалені тканини.
Нещодавно опубліковані дані показують, що завдяки своїм антиоксидантним властивостям, CeO2 NP здатні забезпечити відновлення енергопостачання клітин, за умов навантаження клітини зовнішніми АФК (1, 20). Падіння мітохондріального мембранного потенціалу, вхід кальцію, зниження співвідношення NAD/NADH і концентрації АТФ, викликаного обробкою перекисом водню первинних кіркових клітин відновлювалися після введення CeO2 NP (1). Ми припускаємо, що CeO2 NP може поліпшити вироблення енергії і в інших фізіологічних і патологічних станах. Ми зробили модель LPS-індукованого запалення легенів у щурів з метою вивчення впливу лікування CeO2 Н.П., оцінюючи морфології легенів, продукцію АКФ, експресію прозапальних цитокінів, поглинання кисню і інших характеристик вентиляції легенів.
Деякі автори вважають здатність CeO2 акумулюватися в тканинах як перспективну, так як один раз введені наночасточки CeO2, можуть залишатися в пошкоджених клітинах протягом тривалого часу та продовжувати свою цитопротекторну дію (1). Проте, накопичення CeO2 в тканинах у неконтрольованій концентрації є небезпечним так як у більш високих дозах CeO2 NP стають токсичними. Через їх низьку токсичність і легкого видалення з організму, наночастки діоксиду кремнію, широко використовуються в якості нано- носіїв для токсичних препаратів (21). Для цього дослідження ми використовували СеО2 Н.П., іммобилизованного на наночасточках діоксиду кремнію сферичної форми, щоб уникнути потенційного токсичної ефекту накопичення CeO2.
Будова експерименту.
Моделлю запального процесу обрали пневмонію, індуковану ліпополісахаридами (ЛПС) характерними для клітинних мембран кишечної палочки. Поява цих структур у крові сприймається імунною системою як бактеріальна інвазія, при чому запускається каскад запального процесу. ЛПС вводили за допомогою внутрічеревної ін’єкції. При такому способі введення формується запалення легень, яке супроводжується сепсисом, і тому така модель дає можливість вивчати протизапальні ефекти досліджуваної речовини як на рівні тканини (легені), так і в організми в цілому (кров та її фракції). Для того, щоби довести, що сама процедура ін’єкції у черевну порожнину не впливає на досліджувані параметри, ми дослідили ефект введення в черевну порожнину фізіологічного розчину, в об’ємі, рівному розчину ЛПС (приблизно 1 мл). Крім того, ми дослідили групу інтактних щурів, які слугували контролем. Таким чином, ми дослідили 36 щурів Wistar самців, 5 місяців, 250-290 г поділені на 4 групи. 1) простий контроль, 2) контроль із інтраперітонеальним введенням фізіологічного розчину, 3) інтактні тварини, що лікувалися CeO2 NP, 4) тварини з пневмонією, індукованою ЛПС, 5) тварини з експериментальною пневмонією, яку лікували CeO2 NP.
Розчин діоксиду церію (2.5 г/л). Діоксид церію вводили в ротову порожнину через зонд у дозі 6 мг/кг 4 рази протягом дослідження: на початку дослідження, та через 1, 3 та 24 години після початку дослідження, одразу після вимірювання параметрів зовнішнього дихання.
Синтез і характерізація нанокомпозитів CeO2/SiO2
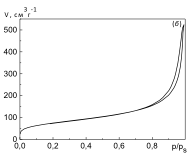
Синтез іммобілізованих наночастинок діоксиду церію здійснювали піролізом зразків пірогенного кремнезему з нанесеним з етанольного розчину амоній церій(IV) нітратом (NH4)2Ce(NO3)6. Питома площа поверхні вихідного непористого кремнезему, що визначена з ізотерм низькотемпературної ад(де)сорбції азоту (рис. 1), становила 273 м2/г. Після нанесення солі церія та термообробки питома поверхня кремнезему дещо зменшується .
Рис. 1. Ізотерма ад(де)сорбції азоту при температурі 77 К вихідним пірогенним кремнеземом А‑300 (Калуський дослідно-експериментальний завод, Україна), що вимірювана за допомогою автоматичного аналізатора Micromeritics ASAP-2000 (Micromeritics, США).
В процесі термічної обробки нанесена сіль церію розкладається та після видалення летких продуктів (аміак, оксиди азоту) в поверхневому шарі кремнезему формуються частинки діоксиду церія. Наявність таких частинок на поверхні носія була підтверджена методом рентгенофазового аналізу (рис. 2). Середній розмір кристалітів (D) визначали по методиці для полікристалічних твердих тіл згідно з рівнянням Шерера: , де l ‑ довжина хвилі рентгенівського випромінювання; q – бреговський кут; B ‑ уширення піку. Згідно одержаних даних, середній розмір наночастинок діоксиду церію, що утворилися в поверхневому шарі кремнезему, становить 6-8 нм.
Рис. 2. Спектр дифракції рентгенівських променів іммобілізованими наночастинками діоксиду церію, який одержано за допомогою дифрактометра ДРОН-4-07 (Росія) з використанням CuKa–випромінювання.
Деякі характеристики поверхні (ізоелектричної точки, поверхнева щільність заряду, дзета потенціал) і середній розмір частинок вихідного носія (SiO2) і частки з іммобілізованим діоксиду церію (CeO2 / SiO2) були оцінені за допомогою Zetasizer Nano ZSTM (Malvern Instruments, Великобританія) , Ці дані представлені в таблиці 1. щільності поверхневого заряду наночастинок (s) були виміряні в 0,01 М розчині KCl при концентрації дисперсії (С) 3 мг / мл.
Таблиця 1. Поверхневі характеристики частинок вихідного носія (SiO2) і частинок з іммобілізованим діоксиду церію (CeO 2 / SiO 2)
| Sample | C, mg/ml | IEP, pH | Surface charge density
mC/cm2 (at pH 7) |
Zeta-potential, mV (in water) | Particles size, nm
(average) |
| SiO2 | 3 | 2.40 | -0,02 | -7.6 | 56 |
| CeO2/SiO2 | 3 | 3.68 | -17.22 | -4.5 | 220 |
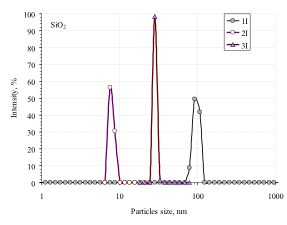
Розмір частинок розраховується як середнє значення з трьох циклів сканування, були виконані без порушення початкової дисперсії води в зразку. Значення рН було в діапазоні 5.2-6.0 (рис. 2).
Рис. 2. Частинки розподіл за розмірами для SiO2 (а) і CeO2 / SiO2 (б) зразки в результаті трьох послідовних вимірювань (криві 1I, 2I, 3I і 1, 2, 3, відповідно) протягом 10 хв.
Значне збільшення діаметра частинок зразків CeO2 / SiO2 імовірно може статися через істотних змін поверхневої густини заряду s (рис. 3) і дзета-потенціал значення (таблиця 1). Такі характеристики можуть значно зменшити колоїдну стабільність водних дисперсій і, таким чином, певні розміри відповідають конгломератів, а не окремих частинок.
Рис. 3. Поверхнева щільність заряду частинок СеО2 / SiO2 при різних значеннях рН.
Експериментальна пневмонія.
Щурам внутрібрюшинно вводили LPS (lipopolysaccharide (Escherichia coli 055:B5; Sigma, St. Louis, MO, USA) в дозі 1 мг/кг, щоб викликати ендотоксемію та запалення легень.
Легенева вентиляція.
Параметри зовнішнього дихання та газообміну вимірювалися за допомогою дихальної маски на не наркотизованих щурах чотири рази: переб введенням LPS, 1, 3 та 24 години після введення LPS. В групах контролю, та інтактних, лічених CeO2 NP щурів ці параметри вимірювалися таким самим чином. Перед декапітацією тварини наркотизуються, проводиться трахеотомія та інкубація, і потім знову вимірюються параметри зовнішнього дихання та газообмін.
Установка для вимірювання патерну зовнішнього дихання і газообміну у дрібних лабораторних тварин включала спеціальну маску для дихання заклинює типу, датчик тиску і мас-спектрометр типу МХ6202. Дані від датчика тиску і мас-спектрометра надходили на аналогово-цифровий пребразователь а потім в комп’ютер. Аналіз даних проводився на оригінальному програмному забезпеченні, розробленому в відділі по вивченню гіпоксичних станів. Спеціально проведені виміри показали, що інерційність датчика мас-спектрометра починає позначатися при частоті дихання, що перевищує 200 (для кисню) і 150 циклів на хвилину для вуглекислого газу. У цьому випадку, коли частота дихання в експерименті досягала зазначених величин, облік інерційності приладу проводився програмно, з використанням спеціальних калібрувальних кривих.
Комп’ютерний аналіз пневмотахограмми проводився по розробленими нами програмами в реальному режимі часу і включав розрахунок тривалості вдиху, видиху, дихального циклу, частоти дихання, дихального обсягу (шляхом інтегрування на вдиху миттєвих значень швидкості газового потоку), максимальне значення швидкості потоку на вдиху і видиху.
Парціальні тиску респіраторних газів в кінці видиху використовувалися в якості альвеолярних. Середні значення цих показників під час видиху вимірювали шляхом інтегрування кривих О2 і СО2 і використанні для визначення споживання кисню, виділення вуглекислого газу, дихального коефіцієнта і ефективності зовнішнього дихання в кожному циклі. Також розраховувалася альвеолярна вентиляція по кисню, функціональне мертве дихальне простір і показники ефективності дихання: вентиляційний еквівалент кисню і кисневий ефект дихального циклу. Дані для кожного дихального циклу усереднювати по 10-20 дихальним циклам. Швидкість газообміну визначали в кожному дихальному циклі з урахуванням його тривалості.
Отримані дані виражали в мл / хв на 1 кг маси тіла в системі BTPS для респіраторних обсягів і STPD для метаболічних показників (249), а потім усереднювати по 10-20 наступними один за одним дихальних циклів. Для отримання середніх величин суму творів значень показників на тривалість циклу ділили на суму тривалостей періодів циклу. При цьому в якості тривалості дихального циклу використовували часовий інтервал між початком поточного і наступного вдиху, що визначаються за допомогою екстраполяції до максимуму другої похідної досліджуваного показника в часі (22).
Виділення РНК, зворотна транскрипція, полімеразна ланцюгова реакція (ПЛР) в режимі реального часу.
Фактор некрозу пухлини (TNF)-α, інтерлейкін 6 (IL)-6, індукований цитокінами хематрактант нейтрофілів (CINC2) вимірюються в гомогенаті легеневої тканини за допомогою ПЦР в реальному часі.
Загальну РНК виділяли з легких з використанням набору Trizol РНК-Prep (Isogen, Росія) відповідно до протоколу виробника. Концентрацію РНК визначали за допомогою спектрофотометра NanoDrop ND1000 (NanoDrop Technologies Inc, США).
Зворотну транскрипцію проводили з використанням RevertAidTM H Minus First Strand cDNA Synthesis Kit (Fermentas, Germany), з використанням 1,2-1,5 мкл тотальної РНК і ремдомного гексамерного праймера. Отриману одноланцюгову ДНК використовували для ПЛР.
ПЛР в реальному часі для експресії мРНК генів TNFa, IL6, Cxcl2.
Ми проводили ампліфікації в 10 мкл SYBR Green PCR Master Mix (Thermoscientific, США), що містить 20 мкм кожного праймера. Для ампліфікації генів TNFa, IL-6, Cxcl2 і ACTB (бета-актину, ген домашнього господарства) ми використовували праймери:
TNFa Up: 5`-CCTCAGCCTCTTCTCATTCCT-3`
TNFa Dw: 5`-GGGAACTTCTCCTCCTTGTTG-3`
IL6 Up: 5`-CAAGAGACTTCCAGCCAGTTG-3`IL6 Dw: 5`-TGGGTGGTATCCTCTGTGAAG-3` Cxcl2 Up: 5`-AGGCTAACTGACCTGGAAAGG-3`Cxcl2 Dw: 5`-ATCAGGTACGATCCAGGCTTC-3`
ACTB Up: 50-TCATCACTATCGGCAATGAGC-30
ACTB Dw: 50-GGCCAGGATAGAGCCACCA-30
Об’єм проби доводили до 20 мкл деионизированною водою. Ампліфікацію проводили на 7500 System PCR Fast Real-Time (“Thermoscientific”, США). Програма ампліфікації складалася з початкової стадії активації AmpliTaq Gold_ ДНК полімерази при 95 ° С протягом 10 хв протягом наступних 50 циклів: денатурації (95 ° С протягом 15 сек), відпалу і подовження (56 ºC протягом 60 с). Для контролю специфічності, ми провели етап дисоціації шляхом послідовного підвищення температури від 56 до 99 градусів Цельсія з реєстрацією комплексів міцності двухцепочечной флуоресценції краплі в ДНК-SYBR Green. Ми провели розрахунки з використанням програмного забезпечення 7500 Fast System SDS. Граничний цикл (СТ) визначається як число циклів, необхідних для флуоресцентного сигналу, щоб перевищити поріг виявлення. Ми розрахували експресію гена-мішені по відношенню до гену домашнього господарства як різницю між граничними значеннями двох генів.
Гістологічний аналіз.
Часточки легеневої тканини фіксуються та забарвлюються гематоксиліном та еозином, з кожної проби виготовляється по 5 зрізів, аналізуються за допомогою світлової мікроскопії та оцінюються напівкількісним методом. Для морфологічного вивчення шматочки легень після фіксації 10%-м нейтральним формаліном обробляли за загальноприйнятою гістологічною методикою і заливали у парафін. Зрізи фарбували гематоксилін-еозином і піддавали світлооптичному дослідженню. Морфологічну оцінку змін гістоструктури печінки проводили за розробленим нами комплексом показників, найбільш важливих для характеристики розвитку імунного запалення: 1) порушення часточкової структури, 2) дистрофія пневмоцитів, 3) загибель пневмоцитів. Патологічні зміни мікроциркуляторного русла характеризували за такими показниками: 1) розширення судин, 2) повнокрів’я судин, 3) порушення судинних стінок, 4) периваскулярні набряки, 5) тромбоутворення.
Активні форми кисню.
Загальна активність вільних радикалів, та рівень супероксидного аніону в плазмі крові, цільній крові та гомогенаті легень вимірювалися за допомогою люмінал-залежної, люзігенін – індукованої хемілюмінесценції.
Для визначення сумарної інтенсивності свободо-радикального окислення вимірювали інтенсивність люмінол-залежною зимозан-активованої хемілюмінесценції. Оптимальне розведення досліджуваної проби для реєстрації люмінолзавісімой ХЛ підібрано експериментально. Для посилення хемілюмінесценції використовували люмінол (5-аміно-2,3-дигідро-1,4-фталазіндіон), що підсилює хемілюмінесценцію ряду АФК (Н2О2, О2 • -, ОН •, OCl • -, NO •). Для визначення інтенсивності продукції супероксидного аніону вимірювали інтенсивність люцигенина-залежною зимозан-активованої хемілюмінесценції. В цьому випадку для посилення хемілюмінесценції використовували люцигенина (10,10′-диметил-9,9′-біакрідіндінітрат), який вважається відносно селективним індикатором О2 • -.
Для реєстрації хемілюмінесценції в термостатіруемого кювету хемілюмінометре (ХЛМ ЕА-1) поміщають: 1 мл досліджуваної проби; 20мкм люминола (кінцева концентрація) ( «Sigma», США). Через 3-5 хв реєструють спонтанну ХЛ. Потім в кювету додають 0,1 мкг / мл опсонізовані сироваткою крові зімозана ( «Sigma», США) і реєструють индуцированную ХЛ. Проводять вимірювання хемілюмінесценції при 37 ° C і постійному перемішуванні на хемілюмінометре. Протягом 15 реєстрували показання хемілюмінометре. Реєстрація результатів і управління хемілюмінесцентним аналізатором здійснювалася через комп’ютер за допомогою спеціально розробленої програми.
Визначали наступні характеристики хемілюмінесцентний кривої: максимальне значення інтенсивності Imax, що відображає максимальний рівень синтезу АФК після додавання стимулу, а також площа S під кривою хемилюминесценции, що характеризує сумарний синтез АФК за 15 хв дослідження, Imin інтегральний показник стану антиоксидантної системи та стійкості компонентів плазми або крові до окислювальному процесу.
Результати.
CeO2 NP зменшують тяжкість експериментальної пневмонії, покращують легеневу вентиляцію завдяки протизапальній та антиоксидантній дії.
Гістологічний аналіз.
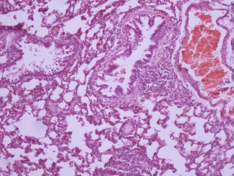
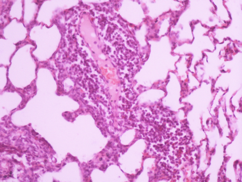
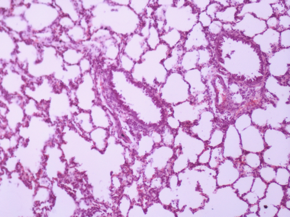
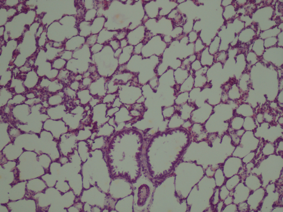
Дані морфологічного дослідження свідчать про те, що введення церію інтактним тваринам не викликає змін у морфології легень. Введення ЛПС викликає суттєві зміни, а саме порушення повітряності легень, порушення часточкової структури, дистрофія пневмоцитів, загибель пневмоцитів, розширення та повнокрів’я судин, порушення судинних стінок, периваскулярні набряки та тромбоутворення. Лікування діоксидом церію призводить до зменшення тяжкості цих змін, тобто, до зменшення вираженості запального процесу (Рис 4).
Рис. 4. Мікрофотографії зрізів легеневої тканини щурів різних груп.
Експресія цитокінів.
Ми не спостерігали будь-яких відмінностей в експресії TNF-alpha, IL-6 і CINC-2 в групі CeO2 NP в порівнянні з контролем. LPS ін’єкція викликало посилену експресію CINC-2 (на 68%), в той час як TNF-α і IL-6 залишилася незмінною. У групі LPS + СеО2 Н.П., спостерігалося значне зниження TNF-alpha, IL-6 і вираз CINC-2. Рівень експресії всіх трьох цитокінів був навіть нижче, ніж у контрольній групі, але не були статистично значущими (Рис. 6-7).
Рис. 5. Експресія TNF-alpha. Значення є середніми ± SE, * р = 0,05 у порівнянні з LPS.
Рис.  6. Експресія IL-6. Значення є середніми ± SE, * р = 0,05 у порівнянні з LPS.
6. Експресія IL-6. Значення є середніми ± SE, * р = 0,05 у порівнянні з LPS.
Рис 7. Експресія CxLx2 значення є середні значення ± SE, * р <0,05 у порівнянні з контролем, ** р = 0,001 у порівнянні з LPS
Інтенсивність вільно-радикального окиснення.
Загальна інтенсивність вільно-радикального окиснення у крові у групі ЛПС за показниками максимального, мінімального спалаху, а також світлосуми була значно (більше ніж у 6 разів) підвищена у групі щурів з ЛПС пневмонією порівняно з контролем (Рис. 8). Це узгоджується з даними морфологічного аналізу про розвиток запального процесу. Введення фізіологічного розчину не впливало на показники, так як і введення діоксиду церію здоровим тваринам.
Спостерігалося значне ( в 2.7 раза) статистично достовірне зниження інтенсивності вільно радикального окиснення у крові щурів із пневмонією під впливом діоксиду церію. Тобто діоксид церію має виражений антиоксидантний вплив на вільно радикальні процеси у цілому організмі (що відображається у крові) при генералізованому запальному процесі.
Рис. 8. Люмінол-залежна активована зимозаном хемілюмінесценція крові контрольних та експериментальних щурів * р<0,05 до групи контроль, ** р<0,05 до групи ЛПС
У гомогенаті легень інтенсивність люзігенін залежної хемілюмінесценції статистично достовірно підвищувалась у групі ЛПС, у порівнянні із контролем, що також узгоджується із картиною запального процесу в легенях (Рис. 9). Введення фізіологічного розчину не впливало на показники, так як і введення діоксиду церію здоровим тваринам.
Лікування ЛПС пневмонії діоксидом церію призводить до достовірного зниження показників: максимального спалаху на 30% та світло суми на 20% , майже повертаючи її до контрольного рівня. Тобто викликана введенням ЛПС підвищена продукція супероксиду в легенях зменшувалась під впливом наночасток ДЦ.
 Рис. 9. Люцигенін-залежна активована зимозаном хемілюмінесценція гомогенатів тканини легень контрольних та експериментальних щурів
Рис. 9. Люцигенін-залежна активована зимозаном хемілюмінесценція гомогенатів тканини легень контрольних та експериментальних щурів
- р<0,05 до групи контроль, ** р<0,05 до групи ЛПС
Таким чином, наночастинки діоксиду церію мають виражений антиоксидантний вплив як в крові, так і в легенях. При цьому він впливає на продукцію су пероксиду, що може вказувати на покращення роботи мітохондрій в умовах запалення.
Зовнішнє дихання.
Було проведено чотири серії досліджень по моделюванню гострої пневмонії за допомогою введення внутрішньобрюшинно модулятора запалення ліпополісахариду (ЛПС), контролю внутришньобрюшинного введення фізіологічного розчину, простого вживання церію та моделюванні запалення легень та лікуванні церієм.
Проводили дослідження по вивченню патерну дихання, газообміну та показників вентиляції альвеол у ненаркотизованих тварин перед введенням препаратів для розвитку запалення і лікуванням в якості вихідних даних, та через одну, три годин після введення і через добу, в якості дослідних даних.
Показано, що при моделюванні пневмонії через добу розвивається зниження енергетичного обміну у щурів, про що свідчить поступове падіння споживання кисню з максимумом через добу (Рис.10). При вживанні церію зростає швидкість споживання кисню через годину і 3 години, та нормалізується через добу. При лікуванні пневмонії церієм, спостерігається накладка двох ефектів – від пневмонії і від церію, проте вираженого падіння споживання кисню через добу, як при пневмонії не спостерігається. Однак слід замітити, що через добу церій в обох цих серіях вводився вже після отримання показників зовнішнього дихання, тому можна припустити, що при зміні моделі експерименту, тобто при вимірювання параметрів зовнішнього дихання після вживання церію можна очікувати продовження ефекту підвищення споживання кисню.
Вентиляція легень при моделюванні пневмонії знижується, з мінімумом через добу (Рис.11). При вживанні церію зростання вентиляції легень найбільш виражено через 3 години, зниження через добу незначне. При лікуванні пневмонії церієм спостерігається зростання вентиляції легень через 1 і 3 години, і зменшення до вихідних величин через добу (церій не вживався).
Динаміка кисневого ефекту дихального циклу віддзеркалює дифузійну властивість легень для кисню, оскільки показує, скільки кисню спожив організм щура за один дихальний цикл і за нашими спостереженнями корелює з морфологічними змінами у легенях щурів при запаленні. Можна побачити (Рис.12), що він порушується при пневмонії, суттєво не змінюється при внутрішньобрюшинному введенні фізіологічного розчину, підвищується при вживанні церію і також знижується при лікуванні пневмонії церієм, проте на відміну від пневмонії при схожій динаміці вираженого падіння споживання кисню не спостерігається. Що може свідчити про менше ураження легень при лікуванні церієм.
Інтегральний показник доставки кисню в альвеоли легень (Рис.13) показує роботу вентиляторного апарату легень по транспорту кисню до альвеол. При запаленні легень він значно знижується, при вживанні церію спостерігається активна доставка кисню, яка повністю забезпечує метаболічні потреби організму. При пневмонії яку лікували церієм, спостерігається схоже зростання цього показника, що може вказувати на стимулюючу дію церію на вентиляцію легень.
Показник екстракції кисню з альвеол (Рис.14) свідчить про забезпечення потреби організму у кисні, або як метаболічний запит організму задовольняється доставкою кисню. Він знижується при пневмонії, практично не змінюється при вживанні церію, і суттєво не знижується при лікуванні запалення легень церієм у щурів.
Таким чином, просте вживання церію стимулює енергетичний метаболізм і роботу систем доставки кисню. Лікування церієм суттєво поліпшує енергетичний метаболізм у хворих тварин і стимулює вентиляторну функцію легень, проте признаки запалення (зниження кисневого ефекту дихального циклу) спостерігаються, хоча і у значно меншій враженості.
 B Введення фізіологічного розчину.
B Введення фізіологічного розчину.
Рис.10 Динаміка змін споживання кисню при моделюванні гострої пневмонії у щурів і лікуванні її церієм (M±m)
 B Введення фізіологічного розчину.
B Введення фізіологічного розчину.
Рис. 11 Динаміка змін вентиляції легень за хвилину при моделюванні гострої пневмонії у щурів і лікуванні її церієм (M±m)
 B Введення фізіологічного розчину.
B Введення фізіологічного розчину.
Рис. 12 Динаміка кисневого ефекту дихального циклу (пов’язаний з дифузійними властивостями легень) при моделюванні гострої пневмонії у щурів і лікуванні її церієм (M±m)
 B Введення фізіологічного розчину.
B Введення фізіологічного розчину.
Рис.13 Динаміка доставки кисню в альвеоли при моделюванні гострої пневмонії у щурів і лікуванні її церієм (M±m)
 B Введення фізіологічного розчину.
B Введення фізіологічного розчину.
Рис.14 Динаміка екстракції кисню з альвеол при моделюванні гострої пневмонії у щурів і лікуванні її церієм (M±m)
Обговорення.
Наше дослідження показало, протизапальну і антиоксидантну дію CeO2NP. Крім того, ми показали, що введення CeO2NP стимулює споживання кисню як у здорових щурів і у щурів із запаленням легенів. Ми пропонуємо механізми цих явищ (1) збільшення ROS продування CeO2NP і вплив цього потужного антиоксиданту на мітохондріальної функції.
LPS активує мембранний TLR4, що призводить до активації білка адаптера MyD88, який ініціює активацію NFκB, МАРК і експресії цитокінів (23).
В яких точках буде антиоксидант впливає на цей ланцюжок подій? Попередні дослідження показали важливу регуляторну роль яку грають АФК в запальній реакції на LPS. Було показано, що в введення ЛПС викликало продукцію АФК в фібробластах, що, в свою чергу, активувало p38 МАРК і JNK. Введення N-ацетилцистеїну, який є антиоксидантом, зменшувало LPS-індуковану експресію прозапальних цитокінів (24).
В імунних клітинах відомі два джерела ЛПС-індукованих АФК. Одним з них є НАДФН-оксидази. АФК, продуковані NADPH-оксидазою відіграють вирішальну роль в LPS-індукованих сигнальних каскадах, що призводять до експресії генів в гліальних клітинах. Інгібітори Phox зменшують LPS-індуковану експресію цитокінів та блокують активацію МАР-кіназ, NFkB і IFNgamma-індукованого STAT1 фосфорилювання (Pawate 25, 26).
Мітохондрії є другим імовірним джерелом LPS-індукованих АФК. У нормальних фізіологічних умовах, ланцюг перенесення електронів виробляє 98% клітин ного су пероксиду. Li X і ін.(27), Повідомили, що мітохондріальні АФК діють в якості сигнальної молекули, щоб викликати прозапальну продукцію цитокінів. LPS-індукована продукція IL-6 була знижена в клітинах, оброблених інгібіторами мітохондріальних АФК, вказуючи, що цей сигнальний каскад має відношення до індукції нормального запальної відповіді. Як LPS впливає на виробництво мітохондріальних АФК? Один із способів можливо шляхом регулювання мітофагії. Після того, як мітохондріальні АФК накопичуються, вони активують інфламасоми NLRP3, які стимулюють накопичення пошкоджених мітохондрій і зменшують подальше збільшення мітохондріальних АФК (28).
Супероксид і інші АК беруть участь в запальних реакціях за посередництвом DAMPS. Основним медіатором ендотоксину шоку є chromatin-associated protein high-mobility group box 1 (HMGB1), який активує TLR2 і TLR4 рецептори декількох імунних клітин, щоб викликати запальні реакції як DAMP (29). Механізми прямого впливу на АФК внутрішньоклітинних посередників при LPS запалення в даний час мало вивчені.
Метаболічний ефект СеО2NP також повинен бути пов’язаний з мітохондріальними АФК. Як уже згадувалося, СеО2NPs збільшує мітохондріальний мембранний потенціал і синтез АТФ під дією АФК (1). Мабуть, в даному випадку СеО2NPs впливають на механізм негативного зворотного зв’язку в мітохондріальної супероксида. Надлишок АФК збільшує проникність метахондріальної пори, що призводить до входу кальцію, падіння мембранного потенціалу, і зменшення синтезу АТФ. Зниження швидкості реакцій в ЕТР також знижує синтез мітохондріальних АФК. Введення антиоксиданту усуває цей ефект і збільшує синтез АТФ.
Метаболічні ефекти, описані нашими дослідженнями побічно показують, що CeO2NP працює як в зовнішньо-, так і у внутрішньоклітинному просторі. Ми поки не знаємо, як частки CeO2NP проникають через клітинну мембрану. Клітинне поглинання наночасток диоксиду кремнію, як відомо, пов’язані з активним ендоцитозом (30). Одним із запропонованих механізмів є взаємодія наночастинок з скавенджер- рецептором А ( 31). Поглинання наночастинок діоксиду кремнію клітиною залежить від дзета-потенціалу і поверхневого заряду частки; показано, що аніонні часточки краще поглинаються клітинами (32). Ефекти CeO2NP на організм вимагає подальшого вивчення для того, щоб стати доповненням до лікування процесів запалення.
Література.
1. Arya A1, Sethy NK, Das M, Singh SK, Das A, Ujjain SK, Sharma RK, Sharma M, Bhargava K. Cerium oxide nanoparticles prevent apoptosis in primary cortical culture by stabilizing mitochondrial membrane potential. Free Radic Res. 2014 Jul;48(7):784-93. doi: 10.3109/10715762.2014.906593. Epub 2014 Apr 15.
-
Gravina N1, Maghni K2, Welman M2, Yahia L3, Mbeh DA3, Messina PV4. Protective role against hydrogen peroxide and fibroblast stimulation via Ce-doped TiO2 nanostructured materials. Biochim Biophys Acta. 2016 Feb;1860(2):452-64. doi: 10.1016/j.bbagen.2015.12.001. Epub 2015 Dec 2.
-
Fiorani L1, Passacantando M2, Santucci S2, Di Marco S1, Bisti S1, Maccarone R1. Cerium Oxide Nanoparticles Reduce Microglial Activation and Neurodegenerative Events in Light Damaged Retina. PLoS One. 2015 Oct 15;10(10):e0140387. doi: 10.1371/journal.pone.0140387. eCollection 2015.
-
Janet M. Dowding, Soumen Das, Amit Kumar, Talib Dosani, Rameech McCormack, Ankur Gupta, Thi X. T. Sayle, Dean C. Sayle, Laurence von Kalm, Sudipta Seal, William T. Self Cellular Interaction and Toxicity Depends on Physiochemical Properties and Surface Modification of Redox Active Nanomaterials ACS Nano. Author manuscript; available in PMC 2014 Jun 25.
-
Jane Ma,a,* Robert R. Mercer,a Mark Barger,a Diane Schwegler-Berry,a Joel M. Cohen,b Philip Demokritou,b and Vincent CastranovacEffects of amorphous silica coating on cerium oxide nanoparticles induced pulmonary responsesToxicol Appl Pharmacol. 2015 Oct 1; 288(1): 63–73.
6. Rice KM1, Nalabotu SK2, Manne ND3, Kolli MB2, Nandyala G3, Arvapalli R3, Ma JY4, Blough ER5. Exposure to Cerium Oxide Nanoparticles Is Associated With Activation of Mitogen-activated Protein Kinases Signaling and Apoptosis in Rat Lungs. J Prev Med Public Health. 2015 May;48(3):132-41.
-
Ying Gao,1Kan Chen,2,* Jin-lu Ma,1,* and Fei Gao3 Cerium oxide nanoparticles in cancer Onco Targets Ther. 2014; 7: 835–840.
-
Atul Asati,†Santimukul Santra,† Charalambos Kaittanis,†‡ and J Manuel Perez†‡§* Surface-Charge-Dependent Cell Localization and Cytotoxicity of Cerium Oxide Nanoparticles ACS Nano. 2010 Sep 28; 4(9): 5321–5331.
-
Pešić M1, Podolski-Renić A2, Stojković S2, Matović B3, Zmejkoski D3, Kojić V4, Bogdanović G4, Pavićević A5, Mojović M5, Savić A6, Milenković I6, Kalauzi A6, Radotić K7. Anti-cancer effects of cerium oxide nanoparticles and its intracellular redox activity. Chem Biol Interact. 2015 May 5;232:85-93. doi: 10.1016/j.cbi.2015.03.013. Epub 2015 Mar 24.
-
Jianli Niu, Kangkai Wang, Pappachan E. Kolattukudy Cerium Oxide Nanoparticles Inhibits Oxidative Stress and Nuclear Factor-κB Activation in H9c2 Cardiomyocytes Exposed to Cigarette Smoke Extract J Pharmacol Exp Ther. 2011 Jul; 338(1): 53–61. doi: 10.1124/jpet.111.179978 PMCID: PMC3126650
-
Salik Hussain, Faris Al-Nsour, Annette B. Rice, Jamie Marshburn, Brenda Yingling, Zhaoxia Ji, Jeffrey I. Zink, Nigel J. Walker, Stavros GarantziotisCerium Dioxide Nanoparticles Induce Apoptosis and Autophagy in Human Peripheral Blood Monocytes ACS Nano. Author manuscript; available in PMC 2015 Sep 25.
-
Melissa S. Wason, Jimmie Colon, Soumen Das, Sudipta Seal, James Turkson, Jihe Zhao, Cheryl H. BakerSensitization of Pancreatic Cancer Cells to Radiation by Cerium Oxide Nanoparticle-Induced ROS Production Author manuscript; available in PMC 2014 May 1.Published in final edited form as: Nanomedicine. 2013 May; 9(4): 558–569. Published online 2012 Nov 22. doi: 10.1016/j.nano.2012.10.010
-
Asano S1,Arvapalli R2, Manne ND1, Maheshwari M3, Ma B1, Rice KM2, Selvaraj V1, Blough ER4. Cerium oxide nanoparticle treatment ameliorates peritonitis-induced diaphragm dysfunction. Int J Nanomedicine. 2015 Oct 5;10:6215-25.
-
Manne ND, Arvapalli R, Nepal N, Shokuhfar T, Rice KM, Asano S, Blough ER.Cerium oxide nanoparticles attenuate acute kidney injury induced by intra-abdominal infection in Sprague-Dawley rats.J Nanobiotechnology. 2015 Oct 24;13:75.
15. Selvaraj V1, Manne ND, Arvapalli R, Rice KM, Nandyala G, Fankenhanel E, Blough ER. Effect of cerium oxide nanoparticles on sepsis induced mortality and NF-κB signaling in cultured macrophages. Nanomedicine (Lond). 2015;10(8):1275-88
-
Kyosseva SV, Chen L, Seal S, McGinnis JF. Nanoceria inhibit expression of genes associated withinflammation and angiogenesis in the retina of Vldlr null mice. Exp Eye Res. 2013 Nov;116:63-74
-
Hashem RM1, Rashd LA2, Hashem KS3, Soliman HM4.Cerium oxide nanoparticles alleviate oxidative stress and decreases Nrf-2/HO-1 in D-GALN/LPS induced hepatotoxicity. Biomed Pharmacother. 2015 Jul;73:80-6. doi: 10.1016/j.biopha.2015.05.006. Epub 2015 May 30.
-
Wong LL1, Pye QN1, Chen L1, Seal S2, McGinnis JF3. Defining the catalytic activity of nanoceria in the P23H-1 rat, a photoreceptor degeneration model. PLoS One. 2015 Mar 30;10(3):e0121977.
-
Minarchick VC, Stapleton PA, Sabolsky EM, Nurkiewicz TR.Cerium Dioxide Nanoparticle Exposure Improves Microvascular Dysfunction and Reduces Oxidative Stress in Spontaneously Hypertensive Rats.Front Physiol. 2015 Nov 17;6:339.
20. González-Flores D1, De Nicola M, Bruni E, Caputo F, Rodríguez AB, Pariente JA, Ghibelli L.Nanoceria protects from alterations in oxidative metabolism and calcium overloads induced by TNFα and cycloheximide in U937 cells: pharmacological potential of nanoparticles. Mol Cell Biochem. 2014 Dec;397(1-2):245-53
21. Baeza A, Vallet-Regí M1. Smart Mesoporous Silica Nanocarriers for Antitumoral Therapy. Curr Top Med Chem. 2015;15(22):2306-15.
-
Pozharov VP. Automatic installation for measuring the volume-time parameters of external respiration and gas exchange in small laboratory animals. Fiziol Zh.1989 Jul-Aug;35(4):119-21).
-
Kawai, Taro; Shizuo Akira (20 April 2010). “The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors”.Nature Immunology. 11 (5): 373–384.doi:1038/ni.1863.
-
Kim DY1,Jun JH, Lee HL, Woo KM, Ryoo HM, Kim GS, Baek JH, Han SB.N-acetylcysteine prevents LPS-induced pro-inflamatory cytokines and MMP2 production in gingival fibroblsts. Arch Pharm Res. 2007 Oct;30(10):1283-92.
-
Pawate S1, Shen Q, Fan F, Bhat NR. Redox regulation of glial inflammatory response to lipopolysaccharide and interferongamma. J Neurosci Res. 2004 Aug 15;77(4):540-51.
-
Menden H1, Welak S1, Cossette S1, Ramchandran R2, Sampath V3.Lipopolysaccharide (LPS)-mediated angiopoietin-2-dependent autocrine angiogenesis is regulated by NADPH oxidase 2 (Nox2) in human pulmonary microvascular endothelial cells. J Biol Chem. 2015 Feb 27;290(9):5449-61. doi: 10.1074/jbc.M114.600692. Epub 2015 Jan 7.
27. Li X1, Wang X1, Zheng M2, Luan QX3 Mitochondrial reactive oxygen species mediate the lipopolysaccharide-induced pro-inflammatory response in human gingival fibroblasts. Exp Cell Res. 2016 Aug 8. pii: S0014-4827(16)30236-1.
-
Naik E1,Dixit VM.Mitochondrial reactive oxygen species drive proinflammatory cytokine production. J Exp Med. 2011 Mar 14;208(3):417-20. doi: 10.1084/jem.20110367. Epub 2011 Feb 28.
-
Gardella S, Andrei C, Ferrera D, et al. (October 2002). “The nuclear protein HMGB1 is secreted by monocytes via a non-classical, vesicle-mediated secretory pathway”. EMBO Rep. 3 (10): 995–1001. doi:1093/embo-reports/kvf198. PMC1307617. PMID 12231511.
-
Bharti C1, Nagaich U2, Pal AK1, Gulati N1. Mesoporous silica nanoparticles in target drug delivery system: A review. Int J Pharm Investig. 2015 Jul-Sep;5(3):124-33. doi: 10.4103/2230-973X.160844.
-
Orr GA1, Chrisler WB, Cassens KJ, Tan R, Tarasevich BJ, Markillie LM, Zangar RC, Thrall BD. Cellular recognition and trafficking of amorphous silica nanoparticles by macrophage scavenger receptor Nanotoxicology. 2011 Sep;5(3):296-311. doi: 10.3109/17435390.2010.513836. Epub 2010 Sep 17.
-
Shahabi S1, Treccani L1, Dringen R2, Rezwan K1. Modulation of Silica Nanoparticle Uptake into Human Osteoblast Cells by Variation of the Ratio of Amino and Sulfonate Surface Groups: Effects of Serum. ACS Appl Mater Interfaces. 2015 Jul 1;7(25):13821-33.
Серебровська Зоя Олександрівна, канд.. біол. наук, доктор біоетики, науковий співробітник Інституту Фізіології ім. О.О.Богомольця НАНУ
Досенко Віктор Євгенович, доктор медичних наук, професор, завідуючий відділом загальної і молекулярної патофізіології Інституту Фізіології ім. О.О.Богомольця НАНУ
Портніченко Володимир Ілліч, канд..мед наук, старший науковий співробітник, вчений секретар Інституту Фізіології ім. О.О.Богомольця НАНУ
Шиш Анжела Михайлівна, канд..біол наук, ведучій науковий співробітник Інституту Фізіології ім. О.О.Богомольця НАНУ
Павлович Світлана Іванівна, канд. біол. наук, наук. cпівробітник Інституту Фізіології ім. О.О.Богомольця НАНУ
Доровських Анатолій Васильович, професор, доктор технічних наук, директор НВО Міжнародний медичний центр “СмартМед”